- 相關推薦
中化學元素化合物解題技巧
中化學元素化合物解題技巧

四川省仁壽縣華興中學 呂名霞
【摘 要】元素推斷題主要考查的是高中學生對元素周期表“位、構、性”關系的理解以及利用物質的結構和性質進行綜合推斷的能力,這類題綜合性較強,涉及知識點較多,所占分值較大,但難度不是特別大,較易得分。學生需要熟悉掌握選修3,必修一元素及其化合物,必修二元素周期表元素周期律以及元素周期表中1-36號元素的結構特點,以及形成化合物的性質特點,綜合分析,得出答案。
【關鍵詞】元素化合物;高中化學;解題技巧;常見考點
(一)對于價電子以及周期表的分布了解
(二)元素推斷:總的來說元素推斷并不難,90%的同學能推出,但要注意條件。
①仔細審題,注意題干要求
比如:X核外共三個能級,各個能級電子數相同,則為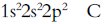
X核外三個能級,s能級與p能級電子數相同,則為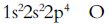
②重要關系式
周期數=核外電子層數 質子數=核電荷數=原子序數=電子數=質量數-中子數
③常見推斷條件
H:最外層電子數與電子層數相等;周期表中半徑最小;某種核素無中子;形成化合物種類最多;離子無電子,單質最輕。
C:形成化合物種類最多;族序數等于周期數的二倍(還可能是Si),最外層電子數等于次外層的二倍;核外三個能級,且各個能級電子數相同;氣態氫化物中氫元素質量分數最高;最高正價和最低負價代數和為零。
N:氣態氫化物水溶液呈堿性;最高價氧化物對應水化物能與氣態氫化物發生反應,空氣中含量最多。
O:最外層電子數等于次外層電子數的三倍;地殼中含量最高,氫化物通常情況下為液態;氫化物沸點最高。
F:周期表中電負性最大;沒有正價。
Na:短周期中電負性最小;短周期主族元素中半徑最大。
Al:地殼中含量最高的金屬元素,最高價氧化物及其水化物既能與酸反應又能與堿反應
(三)常見考點
1、周期表中的位置 答題要規范,第____周期____族
2、位于____區(s區、p區、d區、ds區)
3、電子式 注意結合等電子體
4.電子排布式:價電子、離子、基態原子
電子排布圖或者軌道排布式:價電子、離子、基態原子(強調規范)
原子結構示意圖,離子結構示意圖
5、遞變規律:電負性:同周期從左往右一次增大,同主族從上往下一次減小。
第一電離能:首先想到反常,同周期從左往右一次增大,4>2>3,7>5>6,同主族從上往下一次減小
9.熔沸點:先比較晶體類型,分子晶體最小。晶體類型相同時:
分子晶體:比較范德華力和氫鍵;氫鍵要強于范德華力,一般情況下有氫鍵的熔沸點高(碳原子數大于17的烴熔沸點要高于NH3,H2O較特殊),范德華力比較相對分子質量和分子極性,相對分子質量越大,范德華力越大,氫鍵F-H>O-H>N-H
原子晶體:比較共價鍵的鍵能,鍵能比較鍵長,鍵長比較半徑,成鍵兩原子半徑越大,鍵長越長,鍵能越小,熔沸點越低。
金屬晶體:金屬鍵,半徑越大,金屬鍵越小,熔沸點越低。
離子晶體:晶格能,半徑越大,晶格能越小,電荷越大,晶格能越大。
半徑比較:先比較電子層,電子層數越大半徑越大,電子層數相同時徑小序大
10.晶胞 均攤法:常考晶體的化學式,配位數,微粒個數等
11.化學方程式書寫:利用題干已知信息,注意配平,如果是溶液要注意有H2O
12、熱化學方程書寫:注意配平,狀態,△H的“+”“-”不能省略。
13.配合物:中心原子提供空軌道,配體提供孤電子對,配位鍵屬于共價鍵。
14.溶解度:溶質和溶劑形成分子間氫鍵,溶解度增大;溶質和溶質形成分子間氫鍵溶解度減小。
【參考文獻】
[1]賈碩杰。淺析高考化學元素推斷題。校長閱刊,2008.02
[2]周維為。例談化學元素的有關推斷。考試周刊。2013
[3]王祿。高考化學元素推斷的突破口。高校招生,2009
【中化學元素化合物解題技巧】相關文章:
化學元素的由來08-17
化學元素說課稿03-08
元素化合物在教學中深廣度的把握與體會08-24
鈉的化合物08-17
鐵化合物和亞鐵化合物間相互轉變08-17
化學元素與人體健康教案08-17
化學元素與人體健康的教案12-26
硅及其重要的化合物08-17
鐵和鐵的化合物08-17
鎂、鋁及其化合物08-17